Normal
0
false
false
false
false
EN-US
X-NONE
AR-SA
تولید متراکم
میگو در سیستم پرورشی بیوفلاک
مهدی نادری کوشک* مجید شکاری
اداره شیلات شهرستان بهبهان، اداره کل شیلات خوزستان،
سازمان شیلات ایران، بهبهان، خوزستان، ایران
* نویسنده مسئول: Mahdi.naderi67@yahoo.com
* مقاله مذکور سال 1398 در "مجله ترویجی میگو و سخت پوستان"،
دوره چهارم / شماره 2 منتشر شده است.
چکیده
امروزه توجه به سیستمهای آبزیپروری متراکم به دلیل افزایش سوددهی، امکان
اجرای ایمنی زیستی و کاهش آسیبهای زیستمحیطی در حال افزایش است. یکی از سیستمهایی
که به طور نسبی سودآوری قابل قبولی دارد و هزینههای تولید را کاهش میدهد، فناوری
بیوفلاک است. فناوری بیوفلاک میتواند اهداف آبزی پروری پایدار را با استفاده از
سیستم بدون تعویض آب دنبال کند. این فناوری
به عنوان یک روش جایگزین مؤثر که قادر است اثرات زیست محیطی را کاهش داده و از
ورود عامل بیماری جلوگیری نماید، پیشنهاد شده است. در سیستم بیوفلاک، غلظت
آمونیاک و نیتریت به طور مؤثری کنترل شده و این
امر موجب حفظ سطوح آمونیاک و نیتریت در محدوده قابل قبول برای پرورش میگو حتی
در تراکمهای بالای ذخیرهسازی میگردد. منابع
کربنی مانند ملاس به سیستم بیوفلاک اضافه میشود. منابع کربوهیدرات اضافه شده به
ستون آب در تودهسازی زیستی مؤثر هستند. با اضافه کردن منبع کربنی به استخر،
باکتریها نیتروژن غیرآلی آب را مصرف نموده و توده میکروبی (بیوفلاک) تولید میشود
که میتواند به عنوان غذا مورد استفاده میگوهای پرورشی قرار گیرد. این سیستم برای
پرورش میگو در آبهای غیرمتعارف داخلی و دور از ساحل مناسب میباشد اما اجرایی شدن
این سیستم در جنوب کشور، مستلزم مطالعه پایلوت میباشد که همکاری سازمان شیلات،
محققین آبزیپروری و پرورش دهندگان میگو را میطلبد.
کلمات کلیدی:
فناوری بیوفلاک، تراکم، میگو، رشد، کیفیت آب.
مقدمه
میگو یکی از ذخایر بسیار مهم و ارز آور آبهای کشور را تشکیل داده که به دلیل
دارا بودن ارزش اقتصادی، به عنوان یکی از منابع تأمین پروتئین و درآمد، همواره
مورد توجه قرار گرفته است. در سال 1397 میزان تولید میگوی پرورشی آب شور کشور 47859
تن بوده است (سالنامه آماری سازمان شیلات ایران، 1398). افزایش تولیدات آبزیپروری،
مورد نیاز و قابل پیشبینی است اما مشکلاتی مانند دسترسی به آب و زمین مناسب تولید
را محدود میکنند. راه حلی عملی و قابل قبول از نظر ملاحظات زیست محیطی برای
افزایش تولیدات آبزیپروری استفاده از سیستمهای متراکم است (Avnimelech, 2012). یکی از معضلات مهم زیست
محیطی در صنعت آبزیپروری، تولید و تخلیه حجم زیادی پساب غنی از مواد مغذی (آلی و
معدنی) حاصل از مزارع پرورشی در طبیعت میباشد که خسارت جبران ناپذیری را به محیط
زیست وارد می کند. تعویض آب مزارع پرورش به روش مرسوم سبب هدررفت غذای زنده تولیدی
و نیاز مجدد به توسعه پلانکتونی دارد. بنابراین توجه به سیستمهای آبزیپروری
متراکم به دلیل امنیت زیستی بیشتر و مزایای زیستمحیطی در حال افزایش است. در این
سیستمها برخی از خطرات مانند ورود پاتوژنها و گونههای بیگانه به سیستم پرورش و
مشکلات مربوط به تخلیه آب خروجی که باعث ایجاد آلودگیهای زیستمحیطی میگردد،
کاهش مییابد (Ray, 2012).
برای گسترش تولیدات آبزیپروری باید سه هدف عمده آبزیپروری پایدار را در نظر
گرفت. هدف اول این که توسعه آبزیپروری باید تولیدات بیشتر را بدون افزایش قابل
توجه استفاده از منابع طبیعی (آب و زمین) مدنظر قرار دهد (Avnimelech,
2012). هدف دوم این که توسعه سیستمهای
پایدار که اثرات زیانآوری بر محیط زیست نداشته باشند مورد توجه قرار گیرد (Naylor et al.,
2000) و هدف سوم ایجاد سیستمهایی است که
نسبت هزینه به سود را در جهت حمایت اقتصادی جامعه و پایداری تولید کاهش دهد (Avnimelech, 2012). فناوری بیوفلاک از
سیستمهای آبزی پروری سازگار با محیط زیست است که به عنوان یک سیستم جایگزین موثر
مورد توجه قرار گرفته است.
کنترل آمونیاک در سیستم بیوفلاک
در سیستمهای پرورش متراکم، غلظت بالای آمونیاک یکی از فاکتورهای اصلی محیط
است که موجب استرس و شروع بیماریها میشود. منابع
کربنی مثل آرد گندم، ملاس، شکر و ... به سیستم بیوفلاک اضافه میشود و افزایش نسبت
کربن (10 تا 20) به نیتروژن (1) سبب تقویت جذب نیتروژن توسط باکتریها و تسریع در
کاهش میزان آمونیوم در مقایسه با نیتریفیکاسیون میشود (Crab et al., 2012). منابع
کربوهیدرات اضافه شده به ستون آب در تودهسازی زیستی مؤثر هستند. منبع کربن به
عنوان یک بستر برای سیستمهای عامل بیوفلاک و تولید سلولهای پروتئین میکروبی عمل
میکند. استفاده میکروبها از کربوهیدرات با تثبیت نیتروژن غیرآلی همراه است. این
فرایند به عنوان اساس فرایند میکروبی و به طور ویژه عملکرد هر توده میکروبی میباشد
(Avnimelech, 2012, Avnimelech, 1999).
اضافه کردن کربوهیدرات به سیستمهای بدون تعویض آب برای پرورش متراکم میگوی
سفید غربی به طور قابل توجهی کیفیت آب، فعالیتهای باکتریایی و رشد زئوپلانکتونها
را بهبود میدهد (Gao et al., 2012). نتایج مطالعه Wang و همکاران (2015) نیز نشان داد که
فناوری بیوفلاک به طور مؤثری میتواند غلظت نیتروژن آمونیاکی (NH4+-N)،
نیتریت و نیترات را زمانی که نسبت کربن به نیتروژن بیشتر از 15 به 1 است، در تانکهای
پرورشی کاهش دهد.
گونههای مناسب برای پرورش در سیستم بیوفلاک
همه گونههای آبزی برای پرورش در سیستم بیوفلاک مناسب نیستند. به نظر میرسد
برخی از ویژگیهای لازم برای دستیابی به عملکرد رشد بهتر مانند مقاومت به تراکم
بالا، تحمل سطوح متوسط اکسیژن محلول (تقریبا 3 تا 6 میلیگرم در لیتر)، تغذیه از
مواد معلق و ذرات غذایی آب، عادت همهچیزخواری و قابلیت سازگاری دستگاه گوارش به
جذب بهتر ذرات میکروبی، بایستی از ویژگیهای گونه مورد نظر باشد. تاکنون گونههایی
از قبیل میگو، تیلاپیا و کپور ماهیان به طور موفقیتآمیز در سیستم بیوفلاک پرورش
داده شدهاند. نتایج مطالعه Supono
و همکاران (2014) نشان داد که بیوفلاک تولید شده در سیستم پرورشی بیوفلاک
هتروتروفیک (باکتریهای هتروتروف نقش اصلی را در این سیستم دارند) به دلیل ارزش
غذایی بالا میتواند به عنوان یک جایگزین غذایی مناسب برای میگو مورد استفاده
قرار گیرد و این محققین سیستم بیوفلاک هتروتروفیک را به عنوان سیستم قابل قبول
برای پرورش میگوی سفید غربی تایید کردهاند.
اثرات تغذیهای توده زیستی تولید شده در سیستم بیوفلاک برای میگو
در فناوری بیوفلاک، تحقیقات در زمینه استفاده از توده زیستی به عنوان یک منبع
پروتئینی متمرکز شده است. تودههای زیستی به عنوان یک منبع غذایی غنی در سیستمهای
بدون تعویض آب تولید شده و در تمام شبانه روز در دسترس آبزی میباشد. سیستم
بیوفلاک یک منبع طبیعی غنی از پروتئین و چربی قابل دسترس در استخر پرورش برای آبزی
میباشد (Avnimelech,
2007). برخی از مواد مغذی (ویتامینها و مواد معدنی) از توده زیستی
موجود در استخر پرورش تأمین میشود. بنابراین بیوفلاک میتواند به عنوان منبع
غذایی مکمل برای آبزی استفاده شود (Xu and Pan, 2014). همچنین جذب مواد مغذی به دلیل وجود مقادیر بیشتری
از اسیدهای آمینه ضروری، اسیدهای چرب و دیگر عناصر غذایی در توده زیستی، بهتر است (Izquierdo et al.,
2006). مصرف تودههای زیستی کارایی استفاده
از خوراک را با بازیافت خوراکهای تهنشین شده و برخی از مواد مغذی دفع شده افزایش
میدهد.
بیوفلاک بر فعالیت آنزیمهای گوارشی میگو اثرات مثبت دارد. تودههای زیستی یا
میکروارگانیسمهای متصل به آن فعالیتهای پروتئازی و آمیلازی بالایی را ارائه میدهند.
این آنزیمهای میکروبی به شکستن پروتئین، کربوهیدرات و سایر ترکیبات غذایی کمک میکنند
و خوراک را به واحدهای کوچکتر تجزیه و هضم و جذب خوراک را تسهیل میکنند (Xu and Pan, 2014).
بیوفلاک با فراهم نمودن پروتئین با کیفیت بالا و اسیدهای چرب ضروری میتواند
استفاده از پودر ماهی را در جیره کاهش دهد. پروفایل اسید آمینه و اسید چرب بیوفلاک
نشان دهنده پتانسیل استفاده از آن به عنوان یک غذای زنده میباشد (Moreno-Arias et al.,
2018). بیوفلاک به عنوان غذای مکمل موجب
کاهش درصد پروتئین جیره و همچنین میزان مصرف خوراک میگردد. با استفاده از سیستم
بیوفلاک می توان میزان غذادهی را در پرورش میگوی سفید غربی کاهش داد و حضور بیوفلاک
سبب بهبود عملکرد رشد و تولید پست لارو میگوی سفید غربی میشود (خانجانی و
همکاران، 1394b).
اثرات بیوفلاک بر عملکرد میگو
بهبود رشد و بازماندگی
میگوی سفید غربی (وانامی) در سیستم پرورش بیوفلاک گزارش شده است. در مطالعه
خانجانی و همکاران (1394a)،
بیشترین میزان رشد پست لاروهای میگوی سفید غربی در تیمار بیوفلاک ملاس و بالاترین
ضریب بازماندگی در تیمار بیوفلاک مخلوط مواد کربنی بدست آمد. همچنین بیشترین ضریب تبدیل
غذایی و کمترین بازده غذایی در تیمار بدون بیوفلاک و دارای تعویض آب مشاهده گردید.
Megahed و Mohamed (2014) به منظور ارزیابی بیوفلاک به عنوان یک جایگزین مناسب برای
پودر ماهی در خوراک میگو مطالعهای انجام دادند. در
این آزمایش، میگوها با سه جیره مختلف (کنترل با جیره 45% پروتئین، بیوفلاک با جیره
25% پروتئین، بیوفلاک با جیره 30% پروتئین) به مدت 150 روز تغذیه شدند. کل محصول
میگو در دو تیمار بیوفلاک به طور معنیداری بالاتر از تیمار
کنترل بود. بنابراین تولید
بیوفلاک از طریق اضافه کردن کربوهیدرات به سیستم پرورش، عملکرد رشد میگو را بهبود
میدهد. علاوه بر این، بهبود معنیدار پارامترهای ایمنی و
آنتیاکسیدانی در سیستم بیوفلاک گزارش شده است (Mansour and
Esteban, 2017; Adineh et al., 2019). بیوفلاک نه تنها منبعی از مواد مغذی مانند پروتئینها،
چربیها، مواد معدنی و ویتامینها میباشد، بلکه میکروبهای طبیعی و ترکیبات فعال
زیستی فراوانی مانند کاروتنوئیدها و ترکیبات محرک ایمنی دیگری فراهم میکند که میتواند
پاسخ ایمنی آبزیان پرورشی را تحریک نماید (Crab et al., 2012).
یافتههای قابل ترویج
سیستم پرورشی بیوفلاک
در فناوری بیوفلاک، جوامع میکروبی توسعه یافته از طریق تنظیم نسبت کربن به
نیتروژن مدیریت میشود که موجب کنترل غلظت نیتروژن غیرآلی در آب میگردد. این تودههای
میکروبی سبب بهبود کیفیت آب می شوند. در سیستم بیوفلاک مواد مغذی به طور پیوسته
بازیافت و مجددا به عنوان غذا در دسترس آبزی قرار میگیرند (شکل 1). عامل محرک
اصلی برای رشد متراکم باکتریهای هتروتروف مصرف کربن آلی است (Avnimelech, 2012). با اضافه کردن
کربوهیدرات به آب استخرهای پرورش و تنظیم نسبت کربن به نیتروژن، باکتریهای
هتروتروف مواد مغذی را جذب نموده و با تشکیل بیوفلاک منجر به حذف نیتروژن آمونیاکی
کل و نیتریت میگردند (Asaduzzaman et al., 2008). بنابراین
اضافه کردن کربوهیدرات به سیستمهای پرورشی متراکم روشی مناسب برای کاهش غلظت
نیتروژن غیرآلی میباشد (شکل 1).
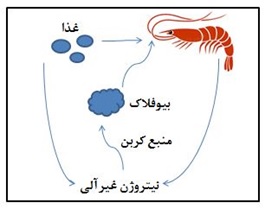
شکل 1 عملکرد بیوفلاک در استخر پرورش میگو
نکته مهم در سیستم بیوفلاک، هوادهی شدید و آن هم از کف استخر میباشد که مواد
آلی استخر را به صورت معلق (سوسپانسیون) نگه دارد تا به مصرف باکتریها برسد و
انباشت مواد آلی اتفاق نیفتد (Azim and Little,
2008).
در سیستم بیوفلاک سه دسته ارگانیسم اثرگذار شامل فتواتوتروفها، شیمیواتوتروفها
و هتروتروفها وجود دارد (Avnimelech, 2012). فتواتوتروفها شامل فیتوپلانکتونها که در حضور نور
کارایی بالاتری دارند و به دلیل دارا بودن کاروتنوئید و اسیدهای چرب غیراشباع
دارای ارزش غذایی بالا هستند. شیمیواتوتروفها مانند باکتری نیتروزموناس که طی
فرایند نیتریفیکاسیون، آمونیاک را به نیتریت و باکتری نیتروباکتر که نیتریت را به
نیترات تبدیل میکنند. باکتریهای هتروتروف (گونههای باسیلوس با فرایند جذب) نقش
اصلی را در سیستم بیوفلاک دارند. در سیستم بیوفلاک، غلظت نیتروژن آمونیاکی کل میتواند
از طریق جذب آن توسط باکتریهای هتروتروف به داخل توده میکروبی به طور مؤثری کنترل
شود (Xu et al., 2016).
در این سیستم، تعداد کل باکتریهای هتروتروف، باسیلوس و ویبریو در توده بیوفلاک
بالا است.
تعویض محدود آب طی دوره پرورش، به حداقل رساندن پساب خروجی و کاهش اثرات زیستمحیطی،
حفظ کیفیت آب، بازیافت مواد مغذی دفعی، تامین غذا، کاهش مصرف پروتئین در خوراک و
در نتیجه کاهش هزینه خوراک، کاهش ضریب تبدیل غذایی و رشد مطلوب، امنیت زیستی و
تولید محصول ارگانیک از مزایای فناوری بیوفلاک هستند. این ویژگیها سیستم بیوفلاک
را به عنوان یک سیستم پایدار برای توسعه آبزیپروری معرفی مینماید.
روش اجرای عملی سیستم بیوفلاک
ابتدا مقدار کربن مورد نیاز روزانه برای رشد بیوفلاک در استخر پرورش میگو
محاسبه میشود. در صورتی که غذادهی روزانه میگو به میزان 4 درصد وزن بدن انجام
شود، به ازای هر یک تن میگوی پرورشی 40 کیلوگرم خوراک به استخر اضافه میشود. اگر
خوراک حاوی 25 درصد پروتئین باشد، روزانه به ازای هر تن میگو 10 کیلوگرم پروتئین
به استخر پرورش اضافه میگردد. از آنجایی که 16 درصد پروتئین نیتروژن میباشد،
بنابراین 6/1 کیلوگرم نیتروژن اضافه شده است. به طور کلی 75 درصد نیتروژن خوراک از
طریق آمونیفیکاسیون (Ammonification) غذای خورده نشده و دفع توسط میگوهای پرورشی
به آب استخر بر میگردد (Piedrahita, 2003). پس روزانه 2/1 کیلوگرم نیتروژن به ازای هر
تن میگو به آب استخر پرورش وارد میشود. میکروارگانیسمها به یک نسبت کربن به
نیتروژن 10 نیاز دارند (Avnimelech, 1999)،
از اینرو 12 کیلوگرم کربن به ازای هر تن میگو برای جذب نیتروژن و تولید بیوفلاک در
استخر پرورش به صورت روزانه مورد نیاز است.
مقدار منبع کربنی اضافه شده به استخر پرورش میگو به محتوای کربن این منابع
بستگی دارد. از آنجایی که 50 درصد وزن خشک بیشتر منابع کربنی را کربن تشکیل میدهد
(De
Schryver et al., 2008)،
بنابراین روزانه 24 کیلوگرم منبع کربنی به ازای هر تن میگوی پرورشی مورد نیاز است.
ماده
کربوهیدراتی (منبع کربنی) درون یک ظرف به خوبی حل شده و سپس به صورت یکنواخت به
استخر پرورش میگو اضافه میگردد.
در طول دوره
پرورش، برای
تعیین میزان مواد
جامد ته نشین شده یا حجم بیوفلاک (Biofloc volume, BFV) روزانه یک لیتر
از آب استخر پرورش میگو داخل قیف مدرج مخروطی شکل ریخته و
به مدت یک ساعت ثابت نگهداری میشود تا ذرات معلق ته نشین شود (شکل 2). سپس میزان رسوب ته نشین شده بر حسب میلیلیتر در لیتر ثبت میشود.
میزان مناسب مواد جامد ته نشین شده
بین 2 تا 40 میلیلیتر در لیتر توصیه شده است (Avnimelech, 2012). با افزایش میزان مواد جامد
معلق، هوادهی بیشتر و کنترل دقیقتری بر فاکتورهای فیزیکوشیمیایی آب در سیستم
بیوفلاک مورد نیاز است و بنابراین بازدید روزانه جهت کنترل میزان آن لازم است.

شکل 2 قیف مدرج مخروطی شکل (Imhoff cone) برای تعیین
میزان مواد جامد ته نشین شده آب استخر
نتیجهگیری
با توجه به
اهمیت صنعت پرورش میگو، مطالعه سیستم بیوفلاک و معرفی آن به این صنعت میتواند اهمیت زیادی داشته باشد که در نهایت
پرورش دهندگان را به سمت بکارگیری این فناوری هدایت نماید. در سیستم پرورشی بیوفلاک، باکتریهای فعال هتروتروف میتوانند نیتروژن زائد را جذب
و تودههای زیستی تشکیل دهند که به مصرف میگو برسد. در نتیجه این سیستم علاوه بر
تقویت ایمنی میگو و امکان اجرای ایمنی زیستی در مزرعه میتواند باعث بهبود عملکرد
میگو (رشد و ضریب تبدیل غذا) شود. همچنین این سیستم باعث بهبود کیفیت آب میگردد.
غلظت نیتروژن آمونیاکی کل و نیتریت به طور مؤثری از طریق جذب هتروتروفیک (جذب نیتروژن آمونیاکی توسط باکتریهای هتروتروف به داخل توده میکروبی) یا نیتریفیکاسیون اتوتروفیک (تبدیل نیتروژن آمونیاکی به نیتریت و سپس به نیترات) کنترل میشود. این امر موجب حفظ سطوح نیتروژن آمونیاکی کل و نیتریت در محدوده قابل قبول برای پرورش میگو حتی
در تراکمهای بالای ذخیرهسازی میگردد.
با استفاده از سیستم پرورشی بیوفلاک علاوه بر صرفهجویی در
مصرف پودر ماهی، کاهش درصد پروتئین جیره و در نهایت کاهش هزینههای تولید، میتوان
به تولید میگوی ارگانیک دست یافت که در بازارهای صادراتی از کیفیت بیشتری برخوردار
بوده و از مزایای زیست محیطی این تکنولوژی نوین پرورشی نیز بهره برد.
با توجه به بومی شدن (اندمیک) بیماری لکه سفید در بیشتر
مجتمعهای پرورش میگوی کشور و حضور دایمی عامل بیماری در آبهای دریایی، رویکرد
جدید شیلاتی پرورش میگو در سیستمهای بدون تعویض آب (مانند سیستم بیوفلاک) است. درحالیکه
این سیستم برای پرورش میگو در آبهای غیرمتعارف داخلی و دور از ساحل مناسب می باشد
اما نکتهای که اجرایی شدن این سیستم در جنوب کشور را مستلزم مطالعه پایلوت میکند،
شوری بالا و میزان تبخیر بالا در مناطق ساحلی جنوب کشور میباشد. بنابراین راهاندازی
این سیستم در مزارع پرورش به عنوان اساس آبزیپروری پایدار میگوی سفید غربی در
کشور نیازمند همکاری سازمان شیلات، محققین آبزی پروری و پرورش دهندگان میگو میباشد.
مطالعه مروری
حاضر نشان میدهد که امکان اجرای سیستم بیوفلاک
برای پرورش میگو به صورت تجاری در جنوب کشور باید بررسی شود.
فهرست منابع
خانجانی، م.ح.، سجادی، م.م.، علی زاده، م. و سوری نژاد، ا. 1394b. تاثیر نسبت های مختلف غذادهی بر کیفیت
آب، عملکرد رشد و بقاء پست لاروهای میگوی سفید غربی (Litopenaeus vannamei Boone 1931) با استفاده از تکنولوژی بیوفلوک.
مجله علمی شیلات ایران، 24، 13-27.
خانجانی، م.ح.، علی زاده، م.، سجادی، م.م. و سوری نژاد، ا. 1394a. تاثیر منابع مختلف کربن بر کیفیت
آب، عملکرد رشد و بقای میگوی سفید غربی ( (Litopenaeus vannamei Boone 1931در سیستم
پرورشی بدون تعویض آب. مجله علمی شیلات ایران، 24، 77-91.
سازمان شیلات ایران، 1398. سالنامه آماری سازمان شیلات ایران 1397-1392. 33
صفحه.
Adineh, H., Naderi,
M., Khademi Hamidi, M., & Harsij, M., 2019. Biofloc technology improves
growth, innate immune responses, oxidative status, and resistance to acute
stress in common carp (Cyprinus carpio) under high stocking density. Fish
& shellfish immunology, 95, 440-448.
Asaduzzaman, M., Wahab, M., Verdegem, M.,
Huque, S., Salam, M. and Azim, M., 2008. C/N ratio control and substrate
addition for periphyton development jointly enhance freshwater prawn Macrobrachium
rosenbergii production in ponds. Aquaculture,
280, 117-123.
Avnimelech, Y., 1999. Carbon/nitrogen ratio as a control
element in aquaculture systems. Aquaculture,
176, 227-235.
Avnimelech, Y., 2007. Feeding with microbial flocs by
tilapia in minimal discharge bio-flocs technology ponds. Aquaculture, 264, 140-147.
Avnimelech, Y., 2012. Biofloc technology, a practical
guide book. The World Aquaculture Society,
Baton Rouge, Louisiana, EUA.
Azim, M.E. and Little, D.C., 2008. The biofloc technology
(BFT) in indoor tanks: water quality, biofloc composition, and growth and
welfare of Nile tilapia (Oreochromis niloticus). Aquaculture, 283, 29-35.
Crab, R., Defoirdt, T., Bossier, P. and Verstraete, W,
2012. Biofloc technology in aquaculture: beneficial effects and future
challenges. Aquaculture, 356, 351-356.
De Schryver, P., Crab, R., Defoirdt, T., Boon, N. and
Verstraete, W., 2008. The basics of bio-flocs technology: The added value for
aquaculture. Aquaculture, 277, 125-137.
Gao, L., Shan, H.-W., Zhang, T.-W., Bao, W.-Y. and Ma, S., 2012. Effects of carbohydrate
addition on Litopenaeus vannamei intensive culture in a zero-water
exchange system. Aquaculture, 342,
89-96.
Izquierdo, M., Forster, I., Divakaran, S., Conquest, L.,
Decamp, O. and Tacon, A., 2006. Effect of green and clear water and lipid
source on survival, growth and biochemical composition of Pacific white shrimp Litopenaeus
vannamei. Aquaculture Nutrition,
12, 192-202.
Mansour, A.T. and Esteban, M.Á., 2017. Effects of carbon
sources and plant protein levels in a biofloc system on growth performance, and
the immune and antioxidant status of Nile tilapia (Oreochromis niloticus).
Fish and Shellfish Immunology, 64,
202-209.
Megahed, M.E. and Mohamed, K., 2014. Sustainable growth
of shrimp aquaculture through biofloc production as alternative to fishmeal in
shrimp feeds. Journal of Agricultural
Science, 6, 176.
Moreno-Arias, A., López-Elías, J.A., Martínez-Córdova,
L.R., Ramírez-Suárez, J.C., Carvallo-Ruiz, M.G., García-Sánchez, G.,
Lugo-Sánchez, M.E. and Miranda-Baeza, A., 2018. Effect of fishmeal replacement
with a vegetable protein mixture on the amino acid and fatty acid profiles of
diets, biofloc and shrimp cultured in BFT system. Aquaculture, 483, 53-62.
Najdegerami, E.H., Bakhshi, F. and Lakani, F.B., 2016.
Effects of biofloc on growth performance, digestive enzyme activities and liver
histology of common carp (Cyprinus carpio L.) fingerlings in zero-water
exchange system. Fish physiology and
biochemistry, 42, 457-465.
Naylor, R.L., Goldburg, R.J., Primavera, J.H., Kautsky,
N., Beveridge, M.C., Clay, J., Folke, C., Lubchenco, J., Mooney, H. and Troell,
M., 2000. Effect of aquaculture on world fish supplies. Nature, 405, 1017-1024.
Piedrahita, R.H., 2003. Reducing the potential
environmental impact of tank aquaculture effluents through intensification and
recirculation. Aquaculture, 226, 35–44.
Ray, A., 2012. Biofloc technology for
super-intensive shrimp culture. Biofloc
Technology-a practical guide book, 2nd ed., The World Aquaculture Society,
Baton Rouge, Louisiana, USA, 167-188.
Supono, H.J., Prayitno, S.B. and Darmanto, Y., 2014.
White shrimp (Litopenaeus vannamei) culture using Heterotrophic
Aquaculture System on nursery Phase. International
Journal of Waste Resources, 4, 142.
Wang, G., Yu, E., Xie, J., Yu, D., Li, Z., Luo, W., Qiu, L. and Zheng, Z.,
2015. Effect of C/N ratio on water quality in zero-water exchange tanks and the
biofloc supplementation in feed on the growth performance of crucian carp, Carassius
auratus. Aquaculture, 443, 98-104.
Xu, W.J. and Pan, L.Q., 2014. Dietary protein level and
C/N ratio manipulation in zero‐exchange
culture of Litopenaeus vannamei: Evaluation of inorganic nitrogen
control, biofloc composition and shrimp performance. Aquaculture research, 45, 1842-1851.
Xu, W.-J., Morris, T.C. and Samocha, T.M., 2016.
Effects of C/N ratio on biofloc development, water quality, and performance of Litopenaeus
vannamei juveniles in a biofloc-based, high-density, zero-exchange, outdoor
tank system. Aquaculture, 453,
169-175.